类器官可以高度模拟和再现人体生理环境和复杂反应,可用于疾病建模,从而研究疾病的发病机制、预测肿瘤患者对药物治疗的个体化反应。
01 模型库建立的标准化流程
模型库中的类器官要达到可应用的标准,除了要保证类器官的种类和数量,更需要严格的质量控制标准。在此基础上,才能保证随时能够对模型库中已有样本进行复苏、扩增和冻存,从而为开 展科学研究或服务于药企等下游客户节省时间成本及人力成本。类器官建库是一项持久、精细、高难度的产出过程,我们始终秉持高标准、严要求的原则,为用户提供高质量的类器官样本,助力生物医药研究和应用转化。

一级库→二级库
一级库样本转为二级库样本前需要进行信息复核(样本来源信息、类器官ID信息)及检测质控(支原体检测、复苏验证、组织及外周血样本配对)。支原体是是实验室中常见的污染细胞的原核生物。多数支原体不会对细胞产生病变效应,使得细胞污染不易被察觉。支原体会改变宿主细胞的结构和功能等特征,造成实验结果不准。我们对所有入库类器官均进行支原体检测,以确保类器官库中的类器官不存在支原体污染,从而保持类器官库的高质量。
二级库→应用
二级库样本在进行应用前将再次进行信息复核(样本来源信息、类器官ID信息)及检测质控(支原体复测、复苏验证、类器官鉴定)。类器官鉴定包括形态学鉴定(HE染色、免疫组化/荧光染色)、基因组鉴定(全基因组或外显子组测序)、STR鉴定,以保证类器官对来源组织的代表性,为后续研究的真实性及可靠性奠定了基础。
02 类器官鉴定
形态学鉴定
类器官的形态学鉴定使用HE染色、免疫组化染色、免疫荧光染色等方法,以明确类器官与来源组织在形态、特征性生物标志物的表达方面具有一致性。
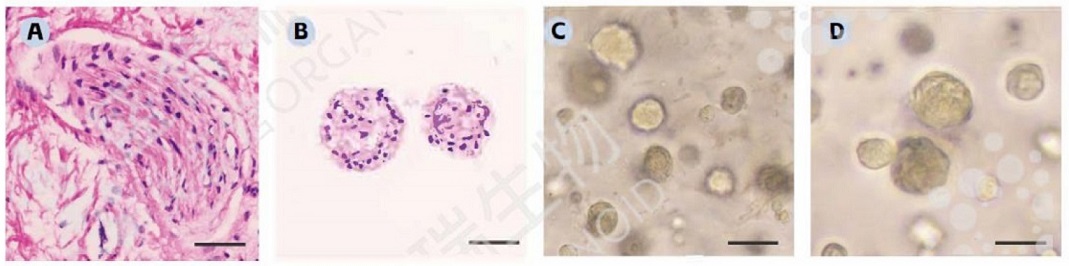
↑ 来源组织与类器官的HE染色:A. 人前列腺癌肿瘤组织HE染色。B. 人前列腺癌类器官HE染色。C. P0代人前列腺癌类器官明场图。D. P1代人前列腺癌类器官明场图。比例尺:100 μm。
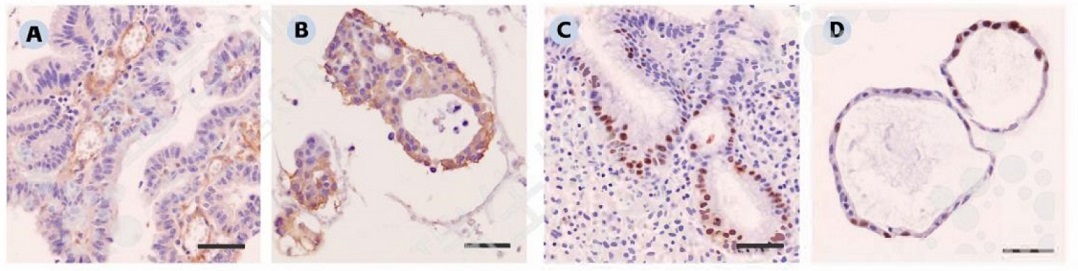
↑ 来源组织与类器官的免疫组化染色:A. 人胃癌肿瘤组织免疫组化染色(CK7)。B. 人胃癌类器官免疫组化染色(CK7)。C. 人胃癌肿瘤组织免疫组化染色(Ki67)。D. 人胃癌类器官免疫组化染色(Ki67)。比例尺:100 μm。
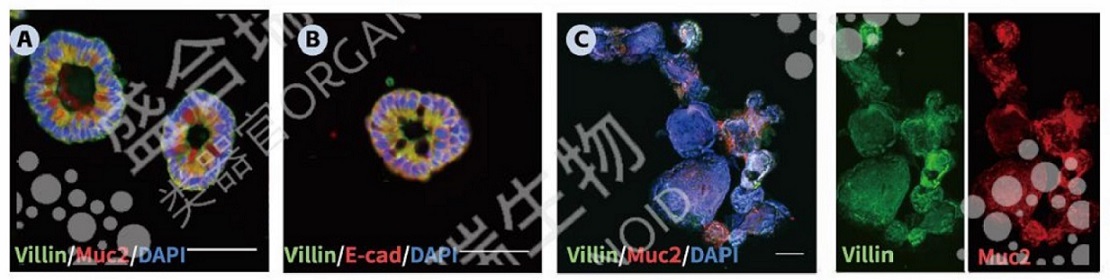
↑ 类器官的免疫荧光染色:A. 小鼠小肠类器官免疫荧光染色结果显示肠绒毛标志物(Villin,绿色)、杯状细胞标志物(Muc2,红色)以及细胞核标志物(DAPI,蓝色)。B. 小鼠小肠类器官免疫荧光染色结果显示肠绒毛标志物(Villin,绿色)、肠上皮细胞标志物(E-cad,红色)以及细胞核标志物(DAPI,蓝色)。C. 小鼠小肠类器官免疫荧光整体染色结果显示Villin(绿色)、Muc2(红色)及DAPI(蓝色)。比例尺:100 μm。
基因组鉴定
类器官的基因组鉴定使用全基因组或全外显子组测序等方法,以明确类器官与来源组织在基因表达、变异等方面具有一致性。为了确定胃癌类器官模型是否保留了原始肿瘤组织的遗传特点,将胃癌类器官及其对应的胃癌组织(n = 8)进行全外显子组测序,分析和比较体细胞单核苷酸变异(SNV)情况。突变景观图(oncoplot)详细展示了前30个常见的胃癌SNV基因情况(图A)。其中,突变最普遍的基因为CSDM1和TTN,在13个样本中被发现。我们还发现各个样本中错义突变(missense)为最常见的的SNV类型,移码突变(frameshift)为最少见的SNV类型。堆叠柱状图(stacked plot)显示,胃癌组织和类器官之间SNV的一致性均超过80%,表明胃癌类器官模型很好地还原了胃癌组织的基因突变谱(图B)。
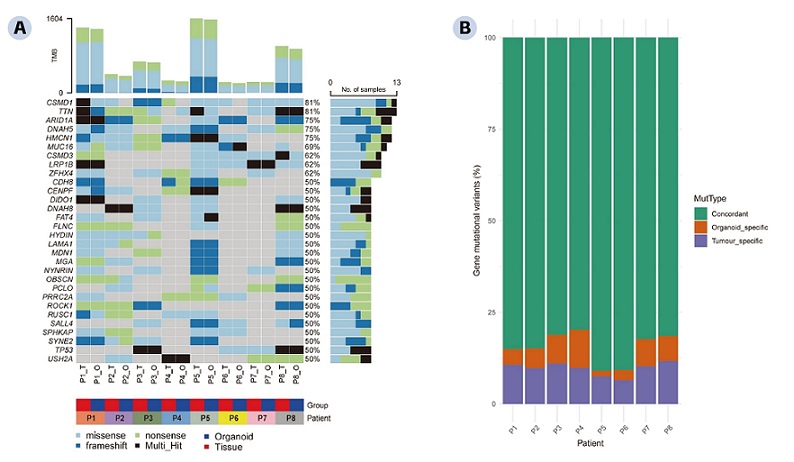
↑ 来源组织与类器官的基因组鉴定:A. 胃癌组织和对应的胃癌类器官样本前30个常见SNV基因突变景观图(n = 8)。X轴上方Panel统计的是各个样本中所有被检测到的肿瘤突变负荷数以及各类型突变在各个样本中的占比。Y轴右侧Panel统计的是前30个常见基因分别在所有样本中突变类型的占比。B. 胃癌组织和对应的胃癌类器官样本SNV一致性统计图(n = 8)。
STR鉴定
STR指的是短串联重复序列(short tandem repeats,STR),也称为微卫星DNA(microsatellite DNA)。STR多态性已经成为法医学中个人识别和亲子鉴定的丰富来源。大量研究表明,STR基因分型方法是进行细胞交叉污染和性质鉴定的最有效和准确的方法之一,被ICLAC、ATCC等权威机构作为金标准应用于细胞鉴定。我们对每一例类器官及其来源组织的STR进行比对,以鉴定两者的一致性,从而保证高质量的类器官模型库。
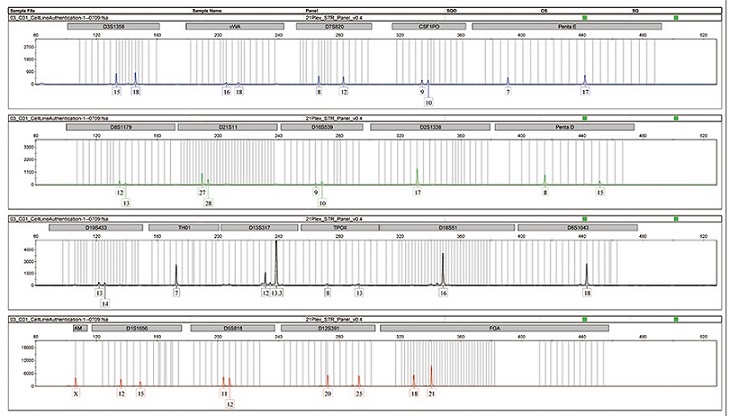
↑ 来源组织与类器官的STR鉴定:人结肠癌肿瘤组织与其来源的结肠癌类器官STR鉴定部分结果。
03 类器官模型类型
将类器官作为模型的研究逐年增加。近年来,类器官模型已成为研究包括肿瘤及非肿瘤疾病在内的多种疾病的主流手段。

非肿瘤疾病类器官模型
值得注意的是,类器官在非肿瘤疾病领域的应用更多,涉及消化道、呼吸道、心血管等多种系统的疾病。此外,类器官在神经退行性疾病、自身免疫性疾病等领域也有较多应用。
肠类器官共培养模型
肠粘膜屏障保护人体内部免受微生物和抗原的侵害,同时允许水、营养物质和特定分子的运输。肠上皮细胞单层排列在肠道表面,并不断进行更新。上皮细胞之间由多种蛋白组成紧密连接,与其他类型的细胞一起共同形成完整的功能调控单元。了解肠道微生物和肠上皮之间复杂的相互作用以及它们如何影响肠道疾病的发生至关重要。为此,利用类器官建立肠粘膜屏障以研究宿主与肠道微生物之间的相互作用,为阐明包括炎性肠病、克罗恩病、溃疡性结肠炎等在内的肠道疾病的发病机制带来了许多新的可能性。
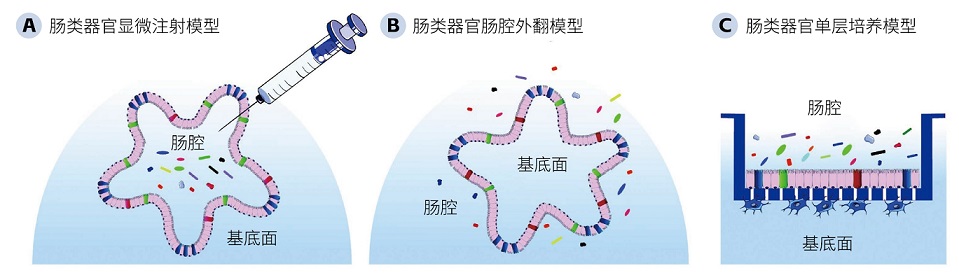
↑ 肠类器官共培养模型的类型:A. 肠类器官显微注射模型。将微生物通过显微注射的方式注射进肠类器官中,缺氧环境有利于研究厌氧菌或兼性厌氧菌。B. 肠类器官肠腔外翻模型。利用螯合剂EDTA破坏二价阳离子依赖的细胞外基质蛋白层中粘连蛋白的聚合,再使用低附着力平板继续悬浮培养类器官后,可获得肠腔“外翻”的肠类器官,其操作简便性优于显微注射模型。C. 肠类器官单层培养模型。将肠类器官消化成小细胞团/单细胞后移植到涂有细胞外基质的Transwell小室上形成单层类器官。微生物可通过添加到培养基中引入,但这种模型无法与严格厌氧菌共培养,因为该培养模型要保持在有氧条件下才能保证类器官的存活。
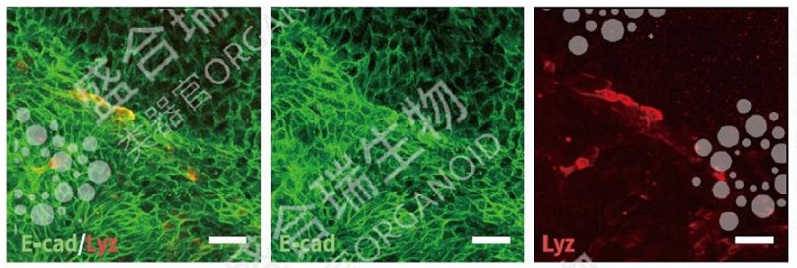
↑ 肠类器官单层培养模型免疫荧光染色:免疫荧光染色结果显示肠类器官构建的单层肠粘膜屏障中存在肠上皮细胞(E-cad绿色)以及潘氏细胞(Lyz,红色)。比例尺: 50 μm。
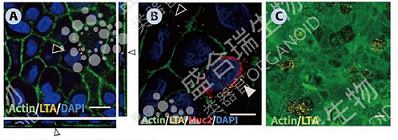
↑ 肠类器官共培养模型相关研究:A. 胎儿小肠类器官源肠粘膜屏障中引入李斯特菌,actin染色细胞骨架(绿色),细菌细胞壁成分LTA染色李斯特菌(黄色)。B. 李斯特菌(黄色)与Muc2染色杯状细胞(红色)的共定位。c. 李斯特菌(黄色)感染部位的actin荧光密度下降(绿色),提示李斯特菌可能引起actin的重新分布。比例尺:10 μm。
04 可提供的类器官模型
我们的疾病模型库中有上千例不同种类的类器官模型,包含肿瘤类器官模型及正常类器官模型,其来源的临床组织、分子及遗传信息、患者临床数据等十分完整,可直接用于开展科学研究、药物开发等应用。
正常类器官模型举例
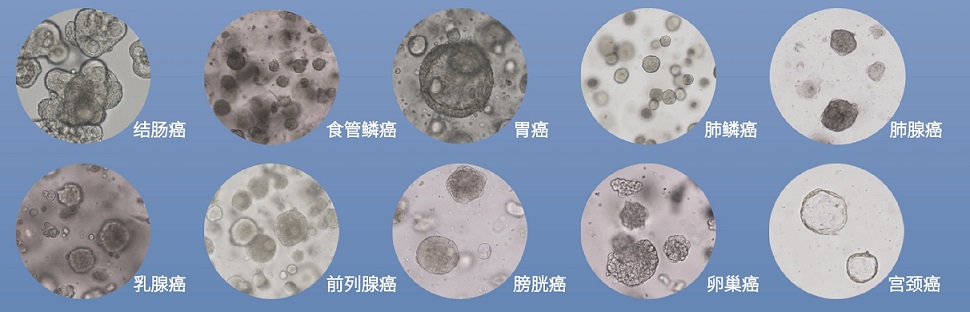
肿瘤类器官模型举例