如何基于类器官开展临床研究与应用?
How to develop clinical research and applications based on organoid?
“类器官”是指细胞在体外的三维(3D)环境中生长,形成微型细胞群,自我组织并分化为功能性细胞,再现体内器官的结构和功能。器官体可以从胚胎干细胞(ESC)、诱导多能干细胞(iPSC)或新生儿/成人干细胞(ASC)中获得,其过程类似于器官获得其独特组织的方式。 类器官内的自我组织需要激活由内在细胞成分或外在环境介导的各种信号途径。ASC衍生的类器官是直接从产后或成人组织中产生的,可以是单个ASC或含有ASC的组织单位。它再现了正常组织稳态下的信号控制。除了正常组织,ASC衍生的类器官也可以从病人特定的材料中建立,用于疾病建模和精准医疗。 另一方面,ESC/iPSC衍生的类器官涉及使用多种生长因子或抑制剂的逐步分化,类似于胃肠发育和器官生成期间的发育。ESC和iPSC的多能性使其能够从三个胚层生成器官。这对研究早期胚胎发育特别有用,因为原始人类材料是有限的。
胃肠道类器官
胃肠道在发育过程中产生于内胚层,形成一个可以分为三个不同区域的管状组织:前肠、中肠和后肠。前肠产生口腔、咽、呼吸道、胰腺、胃和肝脏,中肠产生小肠和升结肠,后肠产生其余结肠和直肠。了解消化道发育和平衡的分子机制和信号调节对建立和维持这些区域的ASC/PSC衍生类器官至关重要。
在成人肠道中,已知Wnt和Egf在隐窝的干细胞维护中发挥关键作用,而Bmp则驱动绒毛的分化。2009年,Sato等人首次描述了从单个Lgr5+干细胞建立的长期3D培养的肠道器官。这些有机体在Wnt激动剂R-spondin、Egf和Bmp抑制剂Noggin的存在下,在基质胶中生长,形成隐窝绒毛结构,并能分化成所有肠道细胞类型,再现了体内小肠的组织和功能。 随后建立了类似的人类结肠、腺瘤和腺癌的长期培养方案。重要的是,这些肠道有机体在小鼠体内的移植显示了对受损结肠上皮的修复,突出了这些三维有机体的再生潜力。在这些成人来源的类器官培养的基础上,进一步建立了人类PSC来源的肠道类器官的改良方案。特别是人造血干细胞首先用激活素A处理以驱动中胚层的特性,然后用Wnt3a和Fgf4促进后肠的分化。 后肠球状体随后在基质胶中按照成人来源的类器官方式进行培养以促进成熟。PSC衍生的肠道类器官与成人衍生的肠道类器官的主要区别是在培养中存在周围的间质细胞,这使得在体内移植时可以在小鼠血管的支持下形成上皮和间质。
胃和肠上皮细胞有许多分子和生理上的相似之处,包括在腺体/囊肿的底部存在增殖的Lgr5+干细胞。在对肠道培养系统稍作修改后,从成年小鼠幽门Lgr5+干细胞或冠状腺Troy+细胞中加入Wnt3a和Fgf10建立了胃器官。一个类似的方法被用于建立人类成年胃器官的长期培养。随后,通过添加Wnt3a、Fgf4、Noggin和维甲酸(RA)来驱动后部前肠的命运,然后在基质胶中进行三维培养以促成熟,从而产生了人类PSC衍生的胃类器官。 这些PSC衍生的器官被认为主要是采用幽门系。
舌及唾液腺类器官
除了肠道和胃,从上消化道的舌头衍生的器官组织也已被建立。最初的方法是用表达Bmi的干细胞从成体舌上皮衍生出舌类器官,形成分层的鳞状上皮,没有唾液尖细胞或味蕾细胞。后来,使用LGR5+、LGR6+或CD44+干/祖细胞建立了味蕾类器官,这些细胞来自有味觉受体表达的环状乳头组织的味蕾。 此外,Wnt信号驱动的小鼠唾液腺器官的长期扩张也有报道。最近有研究表明,转录因子Sox9和Foxc1可以驱动小鼠ESC衍生的口腔外胚层分化为唾液腺器官,这些器官可以在正位移植后成熟为功能性腺体。
肝脏及胰腺类器官
肝脏在发育过程中主要来源于前肠内胚层上皮,该上皮产生肝芽结构,产生肝细胞,随后产生肝细胞和胆汁上皮。一项早期研究表明,解离的小鸡胚胎肝组织可以重新聚集并形成具有功能的胆管的分泌单位。成人肝脏和胰腺在平衡状态下是缓慢循环的。 有研究表明,小鼠的胆管受损后,在胆管附近发现循环的Lgr5+细胞。这些细胞在与基质胶的三维培养条件下生长时,能够生成类器官,并能分化形成成熟的功能性肝细胞。这些肝脏器官主要由表达胆管和肝细胞标记的祖细胞组成,但在移植到小鼠肝病模型中时可以分化成功能性肝细胞。 在一项后续研究中,从人类肝脏中建立了成人胆管衍生的双能祖细胞。2018年,两项研究进一步报道了人类和小鼠肝细胞作为三维类器官培养的成功长期扩增,并具有较高的移植效率。还有人描述了一种替代方法,从人类iPSC生成血管化的人类肝脏。该方案涉及将人类PSC与人类间充质干细胞和人类内皮细胞一起在二维中分化为肝脏内皮细胞。 当在基质胶中生长时,这些细胞自发地形成血管化的三维聚合体,可以进一步在体内移植,形成具有血管网络的功能肝脏。胰腺类器官也可以通过将小鼠胚胎胰腺祖细胞置于基质胶中产生。同样,小鼠和人类的胰腺类器官随后也从成年胰腺中建立,移植后可进一步分化为导管和内分泌系。
大脑类器官
脊椎动物的中枢神经系统在发育过程中来源于神经外胚层。人脑是一个高度复杂的系统,可大致分为三个区域,即前脑、中脑和后脑,它们主要由神经元和胶质细胞组成。以前用来自早期发育的大脑的小鸡神经祖细胞进行解离-聚集实验,在类似于神经管的腔体周围以辐射方式形成了神经上皮细胞群,表明这些脑细胞具有自组织能力。 同样,神经祖细胞(NPC)也有能力在悬浮培养中聚集并形成神经球,有能力分化成神经元和星形细胞。神经球也可以从PSC衍生的胚胎体中产生。最近,从PSC中进一步建立了神经轮回体,它含有围绕着类似神经管的中央腔的NPC。值得注意的是,它们可以进一步被指定为具有不同脑区特征的各种成熟细胞类型。 然而,这些模型在很大程度上仍然是基于二维培养或简单的聚合体,缺乏对大脑发育和功能研究的复杂性。Watanabe及其同事率先从小鼠或人类PSC中发展出不同脑区的三维培养,以再现复杂的脑组织。他们首先通过将小鼠或人类的胚胎体在二维培养中生成前脑组织。 当转移到三维聚集培养时,这些神经上皮细胞形成更复杂的结构,再现了背侧前脑。这种三维培养方法后来被进一步优化,允许类似于早期皮质发育的神经元层的自我组织,可以培养到112天。通过操纵生长因子,如Hedgehog、Fgf、Bmp和Wnt,也可以从ESC发展出不同的大脑区域特性。 2013年,Lancaster等人进一步建立了三维大脑类器官,在单个器官内包含不同的脑区。这些迷你大脑在转移到生物反应器中时可以进一步生长到几毫米,并发展成不同的脑区,包括视网膜、背侧皮质、腹侧前脑、中脑-后脑边界、脉络丛和海马。随后的研究进一步产生了其他类器官培养方法来模拟特定的大脑区域,如中脑特定的类器官,海马类器官和小脑类器官。 使用3D打印技术,进一步生成了一个小型的生物反应器,以便从人类iPSC中低成本地生成前脑特异性器官。
视网膜类器官
神经外胚层的视网膜在发育过程中起源于视囊,视囊的前端内陷形成两个相邻的上皮层:外层视网膜色素上皮和内层神经视网膜。雏鸡视网膜的再聚集实验显示了视网膜在体外的自我组织。当在Wnt2b存在下培养时,这些再聚集物可以进一步组织成正确的层状结构。 后来,小鼠胚胎聚合体的三维培养进一步允许建立类似于早期视网膜的视杯类器官,具有视网膜分层和顶端-基底极性。视杯类器官也可由人类PSC产生。这些人视网膜有机体比小鼠的大,并有能力生长为包含视杆和视锥的多层组织。
肾脏类器官
肾脏通过Wnt和Fgf信号从中间中胚层产生,发展成输尿管芽和元肾间质,形成早期肾管。与其他组织类似,小鸡和小鼠胚胎肾脏的解离-再聚集实验证明了自我组织和形成器官型肾脏结构的能力。2013年,从人类PSC建立了输尿管芽类器官,这些PSC首先在Bmp4和Fgf2中培养以获得中胚层类型,然后暴露于RA、激活素A和Bmp2以产生输尿管芽的肾祖细胞。 这些人类祖细胞进一步与分解的小鼠胚胎肾细胞进行共培养,以自我组织并形成三维输尿管芽结构。此外,通过连续暴露于激活素、Bmp4和Wnt激活剂CHIR99021,然后再暴露于RA和Fgf9,也可以从小鼠EB和人类PSC中产生偏肾间质类型的组织。肾上腺间质与脊髓组织的共培养形成具有组织化肾小管和肾小球的三维结构。 同样,hESC也可以通过原始胚层和中间中胚层分化为输尿管和肾脏祖细胞,当与离体小鼠胚胎肾脏共培养时,进一步形成类似于输尿管上皮和近端小管的三维结构。2015年,通过将人类PSC直接分化成复杂的多细胞肾脏器官,包含与内皮细胞和肾间质包围的集合管网相关的肾小球,建立了一个简化和改进的培养方法。 最近,从成年人或小鼠肾脏组织或人类尿液中进一步建立了肾小管类器官的长期培养,形成近端和远端肾小管段。
其他类器官
除上述组织外,还可以从其他组织中生成类器官组织。例如,Jamieson等人最近从单一的成年乳腺上皮细胞建立了乳腺器官,其中含有被肌上皮细胞包围的极化分泌上皮。前列腺类器官也可以从成年小鼠和人的前列腺上皮细胞中提取,形成管腔和基底细胞。甲状腺类器官是通过转录因子NKX2-1和PAX8的瞬时表达产生的,以诱导小鼠ESC分化为甲状腺滤泡细胞,并在用促甲状腺素处理时形成三维滤泡结构。 通过调节基质的硬度,可以从胚胎体中生成心血管类器官组织。肺类器官可以通过在基质胶中培养成人支气管肺泡干细胞和肺内皮细胞来生成。同样,从支气管肺泡切除术中建立了人类气道类器官组织,包括基底细胞、功能性纤毛细胞、粘液分泌细胞和分泌CC10的杯状细胞。稳定的输卵管类器官也是由人类输卵管建立的,包含纤毛细胞和分泌细胞。 此外,在促进外胚层生长的条件下,垂体类器官也从胚胎体生成,它可以进一步成熟并合成垂体激素。一个类似的培养方法被用来从胚胎体生成内耳类器官,它由具有立体小叶和运动小叶的功能性内耳感觉上皮细胞组成。除了对单个器官进行建模,类器官最近也被用来探索哺乳动物早期的胚胎发育。 胚胎器官或胃膜是通过小鼠ESC在悬浮液中的三维聚集而建立的,在没有外部不对称性诱导的情况下,它们发展成具有极化基因表达的胚胎样结构。这些胚胎类器官自我组织并表现出哺乳动物胃胚的行为,产生了对应于三个胚层的细胞类型,并在与小鼠胚胎相似的时间尺度上进行轴向组织。小鼠胃胚进一步揭示了体细胞发育的动态,突出了这些胃胚作为探索体外早期胚胎发育模型的作用。 在灵长类动物中进一步开发同等的胃胚体系统来模拟人类的体外胚胎发育将是非常重要的。
事实上,除了小鼠和人类之外,类器官技术也已经扩展到了其他动物模型。在不同的物种,如牛、猪、卵、鸡、猫和犬,已经报道了生成肠、乳腺、角质细胞和肝脏类器官的方法。最近的一项研究进一步报道了表达高水平毒素转录物的蛇毒腺体类器官的产生,这有可能被用于毒理学研究。 尽管类器官系统及其相应的培养方法存在多样性,但各系统之间有一些共同的核心生长因子和化学调节剂。绝大多数ASC衍生的类器官是在基质胶悬浮液中培养的,这需要无血清的基础培养基,辅以Wnt激动剂和/或配体(R-spondin,Wnt3a)、Egf和BMP抑制剂(Noggin)。根据其来源组织的信号或激素要求,在培养物中加入额外的生长因子或抑制剂(如肝脏、胃和胰腺类器官中的FGF,胃类器官中的胃泌素,以及前列腺类器官中的双氢睾酮)。 另一方面,ESC/PSC衍生的类器官需要逐步分化的培养方法。值得注意的是,激活素A需要驱动ESC/PSC分化为明确的内胚层,而Fgf和Wnt可以促进神经胚层的分化。从本质上讲,各系统之间培养方案的异同反映了发育和组织稳态过程中的生长信号要求。
类器官的应用
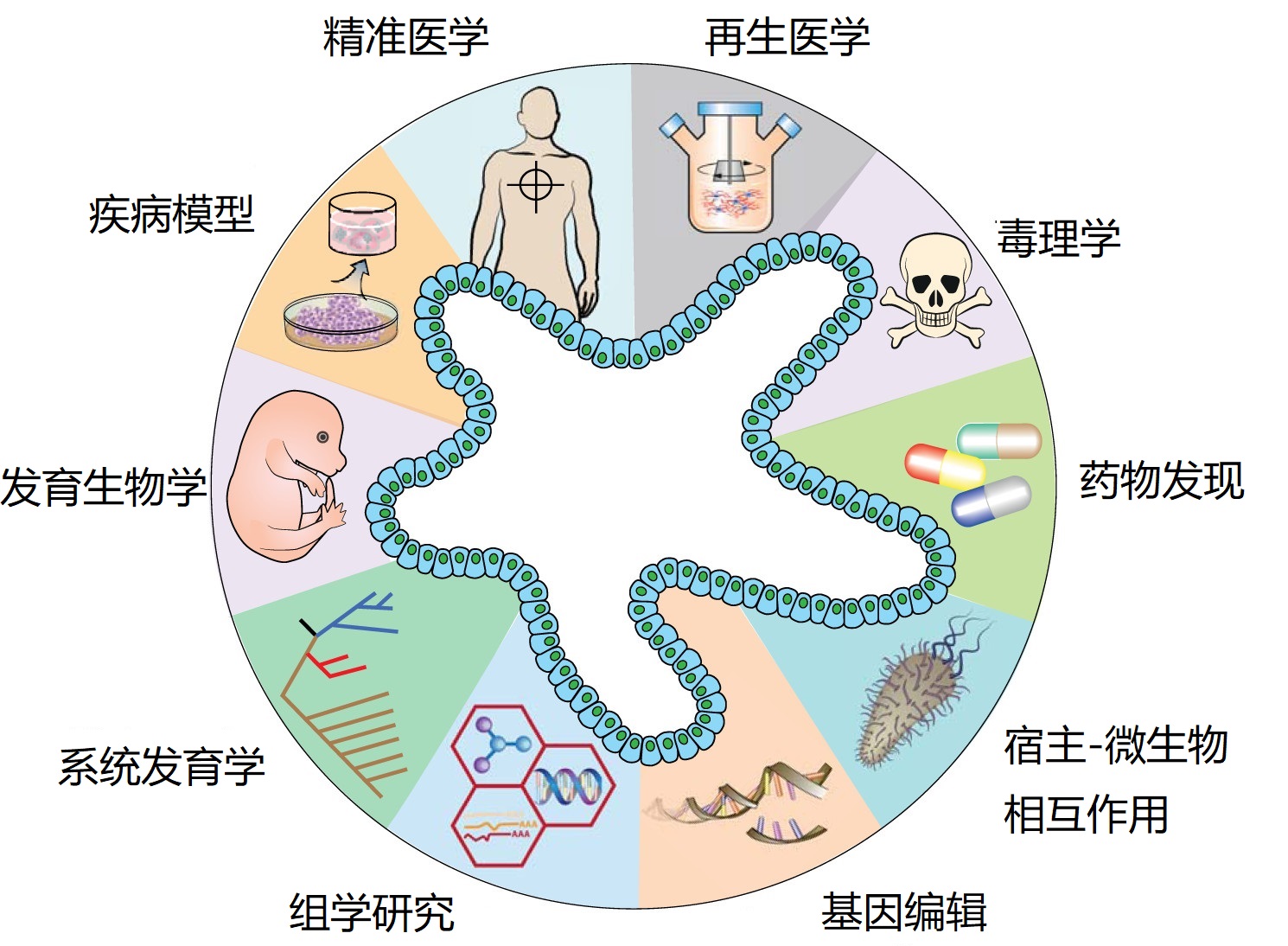
器官体正在成为许多生物医学研究中的主流细胞培养工具之一。类器官广泛的组织类型、长期的扩展能力和生理上的三维结构使其成为许多生物和临床应用的强大新技术。值得注意的是,类器官已被广泛用于发育和疾病建模、精准医学、毒理学研究和再生医学等,如上图所示(Corrò C等人. A brief history of organoids. Am J Physiol Cell Physiol. 2020; 319 (1): C151-C165)。